今回は化学シリーズ第一章として「化学とは何か」を説明します。
よく「科学」との違いが曖昧になる方がおられますが、
「化学」は原子や分子を取り扱う学問、「科学」は生物、物理、化学などの学問全般を指します。

「科学」の狭義の意味として「自然科学」のみを対象とする場合もありますが、
言語学者でない限り「科学=何かを論理的に研究する学問全部」と考えて問題ありません。
論理性(≒科学性)を伴うのならば、哲学や宗教でさえ「科学的」ですので。
さて、話が脱線する前に「化学」の説明に移りましょう。
今回は『化学とは?ー原子と元素の違いは?原子番号の決め方は?』として、化学の基礎をなす「原子」と「分子」を解説します。
スポンサーリンク
化学とは?/原子と元素の違い/原子番号の決め方
化学とは?
「化学」とは、先に述べた通り「原子と分子を研究する学問」です。

少しでも身近に感じていただくために、自然界の構造の説明から始めましょう。
自然界で最も大きい存在は何だと思いますか?
さすがに問題の意図も分かりませんよね。
最上位の階層は「宇宙」です。
宇宙が最大で、そこから徐々に小さな階層(物質)に分解されていきます。

宇宙の中には無数の「銀河」がありますね。
銀河の中には、太陽のような恒星が無数にあり、さらに恒星を周回する惑星があります。
地球という惑星では、その中に多様な生物が生息しています。
さらに、それら生物は一般に細胞によって形成されています。
よって、ざっくり「宇宙 ⊃ 銀河 ⊃ 恒星 ⊃ 惑星 ⊃ 生物 ⊃ 細胞」といった具合です。
ここまできてやっと「分子」の階層です。
細胞に限った話ではありませんが、この世のあらゆる「物質」は分子の集合体として成立しています。
「物質」である以上、例外はありえません。
そういった「分子」を構成しているのが「原子」です。
原子は原子核と電子からなっていて、原子核は中性子と陽子からなります。
さらに、中性子と陽子はクォークからなります。
よって、「分子 ⊃ 原子 = 原子核(=中性子と陽子)+電子」となります。
以上、説明がくどくなってしまいましたが、
化学は分子から下の小さな世界を対象とした学問だということです。
対照的なのは「天文学」で、素粒子を扱う物理学(量子論)とは近しい学問です。
さて、続いては具体的に原子と分子の話へ移行しましょう。
スポンサーリンク
原子とは?「電子と原子番号の決め方」
原子は分子の構成要素で、物質の基本単位です。
原子は直径が10-10m程度の非常に小さな粒子で、
中心には「原子核」があり、その原子核の周りでは負の電荷をもった「電子」が運動しています。
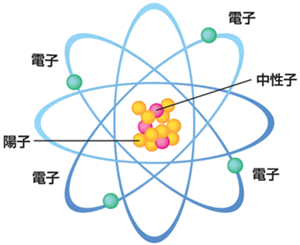
運動といっても無秩序に飛び回っているわけではなくて、きちんと決まった軌道上を周回しています。
原子核の中心にはさらに、正の電荷をもった「陽子」、電荷をもたない「中性子」があります。
このとき電子と陽子の数は同じで、実はこの陽子(電子)の数が「周期表」の番号になっています。
つまり、電子数=陽子数=原子番号となっており、基本的には電子(陽子)が原子番号の決め方のもとになっています。
陽子1個なら水素、2個ならヘリウム、3個ならリチウム……という感じです。
このとき、陽子(電子)の数は同じでも中性子の数だけ違う場合もあって、その原子同士を「同位体」と呼びます。
中性子が異なるだけなので、化学的な性質自体は変わりません。
ちなみに、2023年時点で原子は118種類正式に認められていますが、
これはあくまで合成(発見)できた種類で、今後追記されていくと考えられます。
よく誤解されがちですが、周期表の93番以降の元素+αは人工的に合成されたものです。
※ 検出できていないだけで、自然界に存在している可能性はあります
例えば、IUPACに正式認定されている原子番号112のコペルニシウム(Cn)は、
原子番号30の亜鉛(Zn)の原子核に原子番号82の鉛(Pb)の原子核を、
加速器を使って衝突させることで人工的に合成されています(30+82=112)。
そのため、周期表の元素すべてが自然界に存在しているわけではないことは理解しておいてください。
理論上では「加速器」の改良と観測技術の発展が進めば、173番元素までは検出できる可能性があるとの研究報告はありますが、
実際には、加速器内で衝突させ合成した新元素はすぐに崩壊し観測できないため、観測方法に抜本的革新が必要だと考えられます。
最近でも(2015年)日本初の113番元素(ニホニウム)が正式認定されましたね。
欧米諸国以外では初の快挙で、今後も日本の各種研究所には頑張っていただきたいところです。
原子と元素の違い
ここで「原子と元素の違い」をはっきりさせておきましょう。
特に大学生の中には「原子」と「元素」を混同している方が多くいます。
確かにややこしい上に、大きな誤認にはつながらないのですが、
論文を書く際などにはこれら2つの違いを明確に認識しておく必要があります。
原子は「実体のある粒子」で、元素は「性質を表す概念」です。
ちょうど私たち人間に例えると、原子が「佐藤さんという個人」で元素が「ヒトという概念」に相当します。
現実世界で確かに存在しているものが「原子」、性質や特徴でくくった抽象的な概念が「元素」です。
そのため、先程述べた「同位体」では、中性子が違うので「原子」としては区別しなければなりませんが、
化学的な性質は変わらないので「元素」としては一緒です。
以上、簡単に説明しましたが「原子と元素の違い」は一度覚えてしまえばもう忘れないでしょう。
最後に原子の集合体である「分子」の説明をしていきましょう。
スポンサーリンク
分子とは?「3つの化学結合:共有結合、イオン結合、金属結合」
複数の原子が結合した粒子を「分子」と呼びます。
例えば水(H2O)は、2個の水素原子(H)と1個の酸素原子(O)が結合した分子です。
原子が結合して分子を構成するための「化学結合」は”共有結合”、”イオン結合”、”金属結合”の3つに大きく分類できます。
1、共有結合
2、イオン結合
3、金属結合
1つめの「共有結合」は、不安定な原子を安定させるための結合です。
原子の説明でも述べましたが、原子はきちんと決まった軌道上を運動しています。
その軌道はいくつかあるのですが、軌道ごとに電子がどれだけの数まで周回できるか決まっています。
一番内側の軌道は最大2個まで、その1つ外側の軌道が8個まで、その次が18個…という個数制限です。
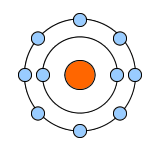
一番内側に3個の電子が入ろうとしても、1個はじかれて1つ外の軌道へと押しやられてしまいます。
逆に一番外側の軌道で回っていたとしても、内側に空きがあれば基本的には内側の軌道に入ろうとします。
ただし『周期表』の記事で詳しく説明しますが、周期表の中央部分(3~11族)の遷移元素は例外です。
このとき、軌道に空きがない方が原子はずっと安定するので、
例えば水素原子の場合では、原子1個よりも軌道の最大である2個のほうが安定します。
そのため、もっと電子が欲しいという別の原子や分子と結合して、軌道いっぱいの原子を獲得しようと動きます。
この不安定な原子を安定させるための結合が「共有結合」です。
2つ目の「イオン結合」は、プラスとマイナスの電気的な引っ張り合いによって生じる結合です。
例えば、電子1個を放出したナトリウム原子(Na+:負の電荷をもつ電子が1個少ないのでプラスになる)と
電子を1個取り込んだ塩素原子(Cl-:電子が1個多いのでマイナス)があれば、
プラスとマイナスで引きあって、塩化ナトリウム(NaCl)ができます。
このような電気的要因に基づく結合が「イオン結合」です。
最後の「金属結合」は、名前の通り金属同士の結合です。
私たちが目視できる「金(きん)」などの金属固体は、金原子が多数「金属結合」した物質ですね。
以上、『化学とは?ー原子と元素の違いは?原子番号の決め方は?』でした!
いかがだったでしょうか?
教科書的な説明になってしまい、少し退屈だったかもしれません。
そもそも化学の記事に需要があるのか不明ですが、次回からは『周期表』の説明に移ります。
体力が持てば全118種の元素をすべて解説するつもりなのですが、20番あたりで挫折しそうな予感がします…。
※ 全118種の元素解説を終了しました<(_ _)>
「化学とは?ー原子と元素の違い・原子番号の決め方」まとめ
化学とは?
・ 化学とは、原子と分子を研究する学問
・ あらゆる物質は分子の集合体として成立しており、分子を構成しているのが原子
・ 原子は原子核と電子からなり、原子核は中性子と陽子からなる
・ よって、分子 ⊃ 原子 = 原子核(=中性子と陽子)+電子
原子とは?「電子と原子番号の決め方」
・ 原子は分子の構成要素で、物質の基本単位
・ 原子の中心には原子核があり、その周りを負の電荷をもった電子が決まった軌道上で運動してる
・ 原子核の中心にはさらに、正の電荷をもった陽子、電荷をもたない中性子がある
・ 電子と陽子の数は同じで、陽子(電子)数が「周期表」の番号に対応している
原子と元素の違い
・ 現実世界で確かに存在しているものが「原子」、性質や特徴でくくった抽象的な概念が「元素」(=違い)
分子とは?「3つの化学結合:共有結合、イオン結合、金属結合」
・ 分子とは、複数の原子が結合した粒子のこと
・ 原子が結合して分子を構成するための化学結合には「共有結合」、「イオン結合」、「金属結合」がある
・ 共有結合は、不安定な原子を安定させるための結合
・ イオン結合は、プラスとマイナスの電気的な引っ張り合いによって生じる結合
・ 金属結合は、金属同士の結合