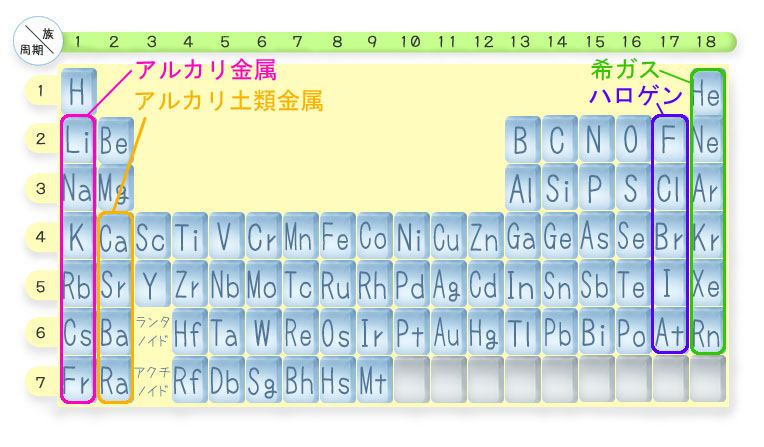
元素1つ1つの特徴を個別にみていく前に、まずは化学的性質の似ている縦の列(=族)の特徴を説明しましょう。

今回は『アルカリ金属|”性質・特徴まとめ” と ”反応性が大きい理由”』として、
周期表の一番左側の列にある、1族の「アルカリ金属」を取り上げます。
スポンサーリンク
アルカリ金属|性質・特徴と反応性が大きい理由
アルカリ金属の性質・特徴
アルカリ金属とは、周期表1族の「水素を除く」元素のことです。
具体的には
原子番号3 リチウム(Li)
原子番号11 ナトリウム(Na)
原子番号19 カリウム(K)
原子番号37 ルビジウム(Rb)
原子番号55 セシウム(Cs)
原子番号87 フランシウム(Fr)
の6つを指します。

このアルカリ金属の最も大きな性質・特徴は「反応性が非常に大きいこと」です。
そのため、保管方法を厳重にしなければならない危険元素でもあります。
あまりナトリウムやカリウムに危険というイメージはないかもしれませんが、
水とでさえ爆発的に反応する非常に危険な元素です。
仮にナトリウム分子そのものを水で濡らせば激しく炎をあげるため、
リチウム、ナトリウム、カリウムの保存は石油の中にするなどの反応を抑える処置が必要です。
この反応性は原子番号が大きくなるとより強くなり、ルビジウムやセシウムは空気中の水分や酸素とすら激しく反応します。
よって、ルビジウム以降の元素に関しては、石油中でなく、空気を抜いた管に保存するなど厳重な注意が必要とされています。
では、一体なぜこれほどまでに「アルカリ金属」は反応性が大きいのでしょうか?
その理由は、前章の『金属元素』でも説明した「最外殻の電子数(=価電子)」に起因します。
スポンサーリンク
アルカリ金属の反応性が大きい理由
すべてのアルカリ金属は周期表の1番左側にありますね。
それはつまり、「価電子が1つだけ」だということです。
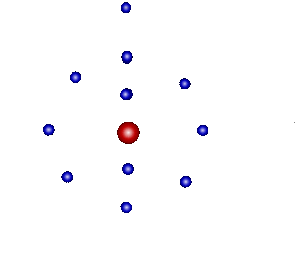
1つだけ余分な電子をもっていることになり、
その1つさえ他の原子や分子に渡してしまえば安定した状態になれるので、
アルカリ金属はさっさと他の元素と結合して安定化を目指します。
そのため、そんな原子が集まったナトリウム分子などは、短い時間で爆発的で大きな反応をみせるわけです。
これが、アルカリ金属の反応性の大きさ理由です。
以上、『アルカリ金属ー”性質・特徴まとめ” と ”反応性が高い理由”』でした!
さて、意外と早く書き終えてしまいました。
アルカリ金属それぞれの性質・特徴を述べるのは骨が折れるので、後回しにします。
次章は、周期表の一番右側(18族)に位置する『希ガスの性質・特徴と安定性の理由』についての説明です。
「アルカリ金属|”性質・特徴まとめ” と ”反応性が高い理由”」まとめ
アルカリ金属の性質・特徴
・ アルカリ金属とは、周期表1族の「水素を除く」元素のこと
・ リチウム(Li)、 ナトリウム(Na)、カリウム(K)、ルビジウム(Rb)、セシウム(Cs)、フランシウム(Fr)の6つが該当する
・ アルカリ金属の最も大きな性質・特徴は「反応性が非常に大きいこと」
・ 反応性は原子番号が大きくなるとより強くなり、ルビジウムやセシウムは空気中の水分や酸素とすら激しく反応する
・ よって、保管には空気を抜いた管を使うなど厳重な注意が必要
アルカリ金属の反応性が大きい理由
・ アルカリ金属の反応性の大きさは、最外殻の電子数(=価電子)が1つだけであることに起因する
・ アルカリ金属はたった1つだけ余分な電子をもっているため、すぐにその余分な電子を他の元素と結合して受け渡そうとする
・ その結果、短時間で爆発的な反応をみせる